STTT:靶向它就能“一石二鸟”!樊嘉院士团队揭示针对剪接因子SRSF1有效抗癌的双重机制
来源:奇点糕 2025-01-31 09:59
抑制SRSF1一方面能够全面提升CD8+T细胞的抗癌能力和促进代谢重编程,另一方面则能降低癌细胞的糖酵解能力,减缓它们的增殖速度,从而“一石二鸟”式地助力现有免疫治疗。
近日,Signal Transduction and Targeted Therapy期刊上发表了同样来自复旦大学附属中山医院樊嘉院士及史颖弘、代智等研究者的研究成果:抑制SRSF1一方面能够全面提升CD8+T细胞的抗癌能力和促进代谢重编程,另一方面则能降低癌细胞的糖酵解能力,减缓它们的增殖速度,从而“一石二鸟”式地助力现有免疫治疗[1]。

论文首页截图
在发现多种实体瘤中均有SRSF1过表达后,既往研究大多都在关注SRSF1对癌细胞的直接作用[2],但以今天的眼光来看,不分析SRSF1对肿瘤微环境其它组分,特别是对免疫细胞的影响可不够。在本次研究中,研究者们一上来就证实,多种人类实体瘤样本内SRSF1的mRNA水平与耗竭CD8+T细胞呈正相关,而与细胞毒性或记忆性T细胞呈负相关。
研究者们又使用肝细胞癌(HCC)细胞展开实验,证实耗竭CD8+T细胞内的SRSF1表达水平显著高于细胞毒性CD8+T细胞,且SRSF1表达水平直接受耗竭相关转录因子NFATC2调控;同时,对PD-1抑制剂新辅助治疗无应答HCC患者的肿瘤组织内,SRSF1表达水平也显著较高,这都说明SRSF1的存在不利于抗肿瘤免疫。
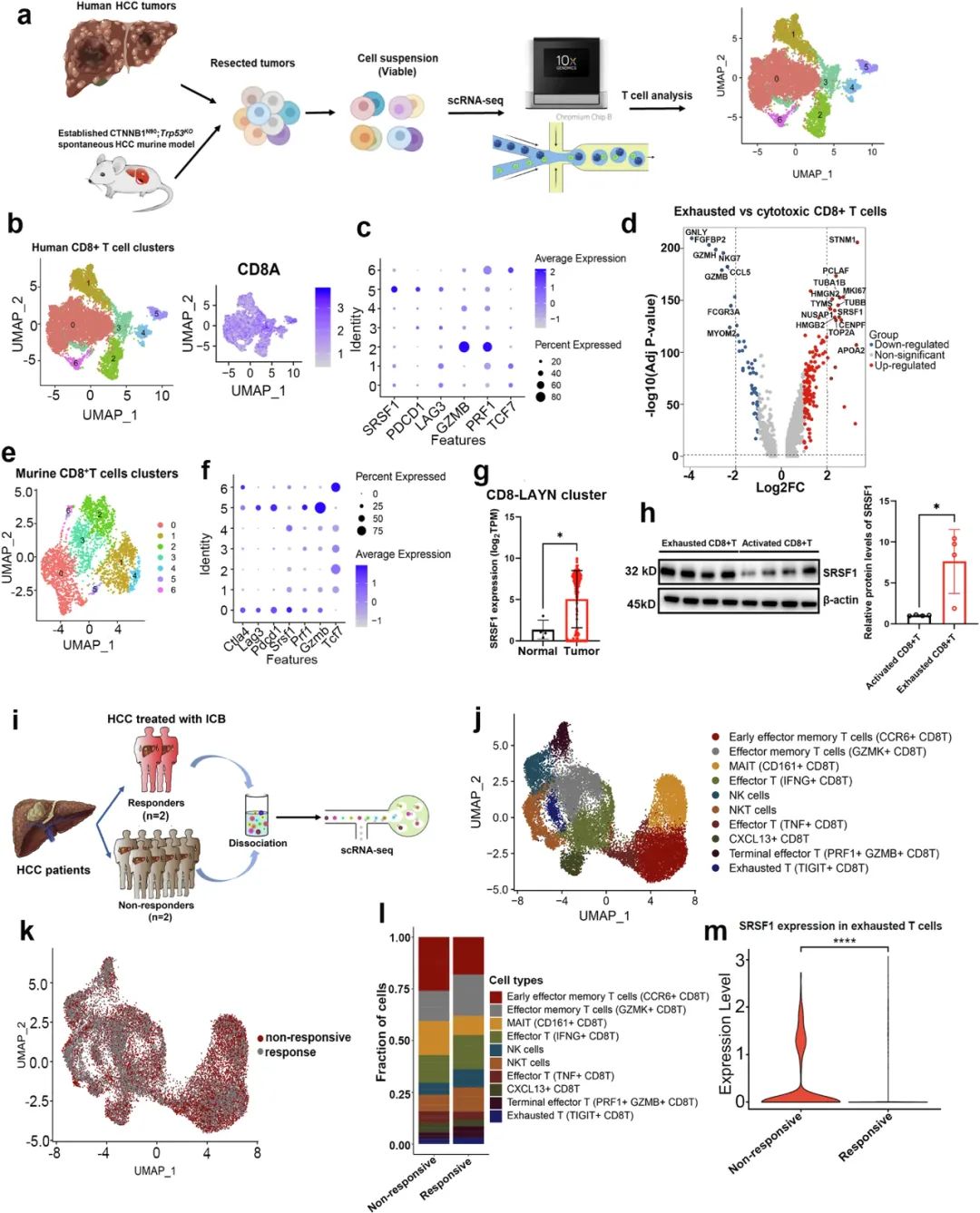
SRSF1表达水平与实体瘤内耗竭CD8+T细胞数量呈正相关
选择性敲除小鼠CD8+T细胞中的Srsf1,就能显著增强它们的细胞毒性,表现为CD8+T细胞抑癌能力上升、且CD38表达上调(提示细胞毒效应更强[3]),肿瘤内也有更多CD8+T细胞浸润,且这种增效对过继性CD8+T细胞疗法也同样成立。自然而然,下一步当然就要分析敲除Srsf1增强CD8+T细胞战斗力的具体机制了。
RNA测序分析显示,敲除Srsf1后的CD8+T细胞不仅发生了细胞毒性相关基因(如Ifng, Gzma)的表达上调,PI3K/AKT/mTOR通路也被显著激活,符合既往研究SRSF1通过上调PTEN表达、抑制mTOR通路活性的发现;研究者们还发现,敲除Srsf1也是使CD38表达上调的直接原因,这是因为SRSF1可通过调控转录因子FOXO1影响CD38表达,另外CD8+T细胞的糖酵解能力也显著增强,又从代谢层面获得了加持。
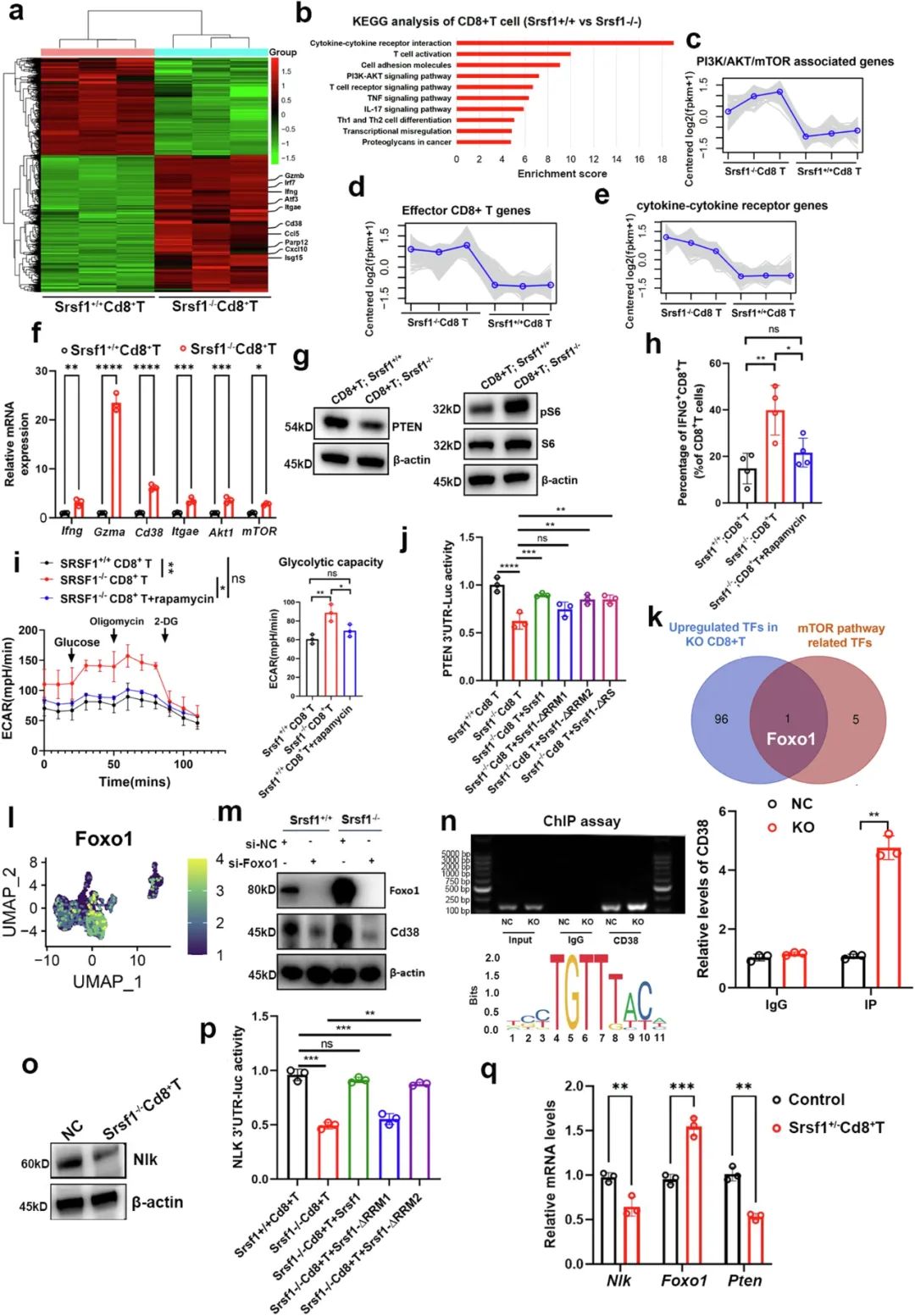
SRSF1可通过调控转录因子FOXO1影响CD38表达
接下来,研究者们用短发夹RNA(shRNA)抑制了HCC细胞SRSF1表达,发现肿瘤生长速度在免疫健全小鼠身上比裸鼠更慢,说明肿瘤内源性的SRSF1也会对T细胞有所影响,同时肿瘤内也有更多功能增强的CD8+T细胞浸润;就癌细胞本身而言,缺少SRSF1后被抑制的则是糖酵解能力,这同样是SRSF1调控转录因子活性,影响糖酵解相关基因表达的结果。
既然抑制SRSF1既会助力CD8+T细胞,又能削弱癌细胞,研究者们最后经筛选开发了一种新型小分子SRSF1抑制剂(TN2008),并证实了它单独使用的抑癌效应和联合PD-1抑制剂时的协同增效作用,希望它能尽快进入临床研究一展身手啦。
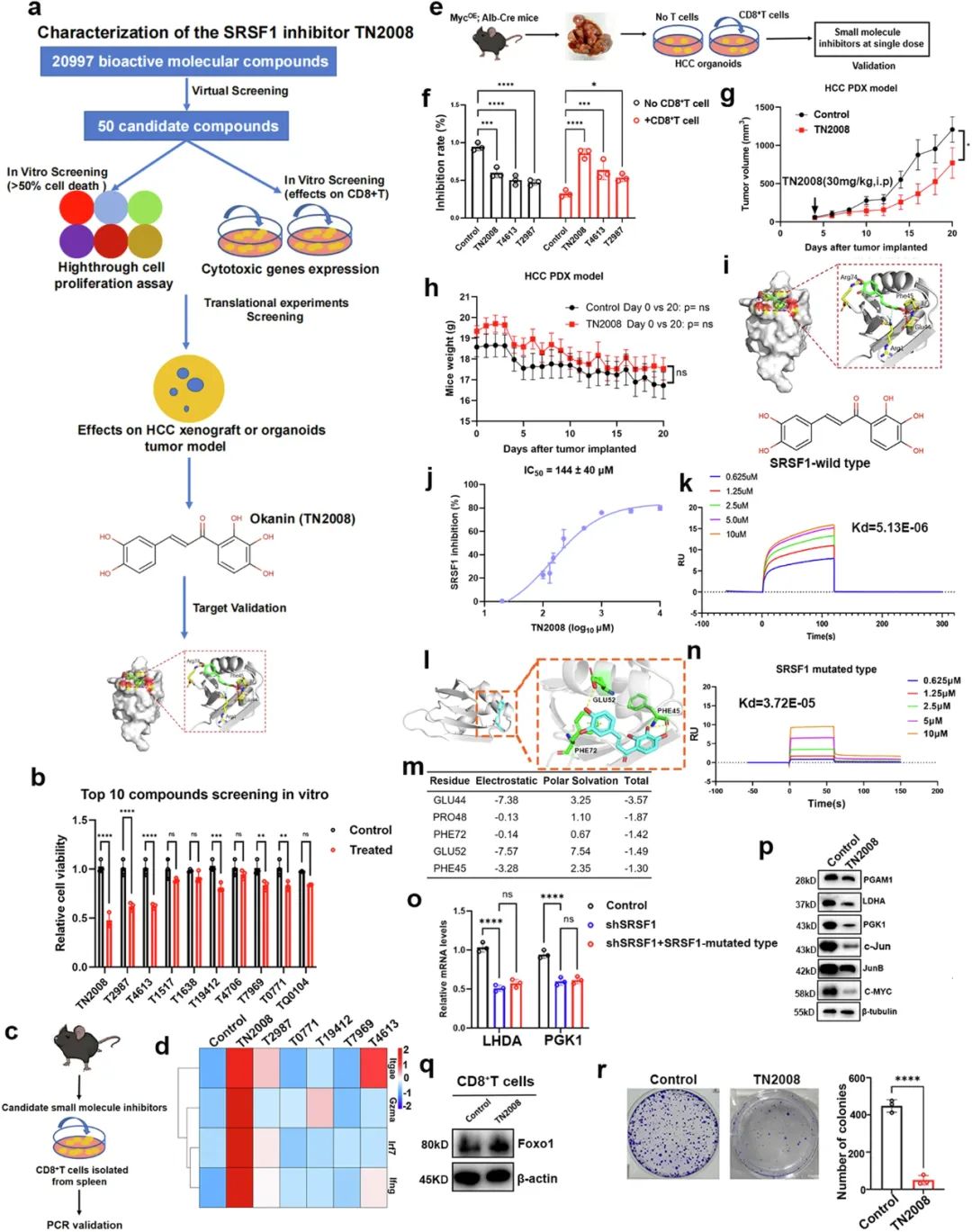
TN2008的发现过程和临床前研究中的抑癌作用
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


